в чем сущность метода нейтрализации
Лекция 6. Область применения метода нейтрализации. Рабочие растворы в методе нейтрализации
Ключевые слова: метод нейтрализации, рабочие растворы, точка эквивалентности,
К методу нейтрализации относят все анализы, в основе которых лежит реакция кислотно-основного взаимодействия. По этому методу можно, пользуясь титрованным раствором какой-либо сильной кислоты, проводить количественное определение оснований (ацидиметрия) или, пользуясь титрованным раствором щелочи, количественно определять кислоты (алкалиметрия). Метод нейтрализации может быть использован для определения солей, подвергающихся гидролизу, и проявляющих кислотно-основные свойства.
НСl + NаОН → NaСl + Н2О.
В точке эквивалентности в растворе будет только образовавшаяся при реакции соль (NаСl) без избытка кислоты или щелочи. Соли сильных кислот и сильных оснований не подвергаются гидролизу и имеют нейтральную реакцию. Следовательно, в точке эквивалентности в рассматриваемом случае рН равен 7. То же будет, очевидно, и при титровании сильной щелочи сильной кислотой.
Однако если сильную кислоту заменить слабой, например, уксусной кислотой, то при титровании происходит следующая реакция:
В точке эквивалентности в растворе будет присутствовать соль СН3СООNа, гидролиз которой протекает по схеме
Гидролиз ацетата натрия сопровождается накоплением ионов ОН – и приводит к возникновению щелочной реакции раствора. Следовательно, заканчивать титрование уксусной кислоты нужно не при рН=7, как в случае титрования НСl, а при рН>7.
При титровании слабых оснований сильными кислотами
в точке эквивалентности реакция раствора определяется гидролизом соли по катиону, приводящим к накоплению ионов Н + :
Следовательно, при титровании слабого основания сильной кислотой рН в точке эквивалентности должен быть меньше 7 (рН
Продуктами реакции являются слабые кислоты (H3BO3 и H2CO3), следовательно, в точке эквивалентности в растворе среда кислая, поэтому титрование проводят в присутствии метилоранжа. Точную концентрацию кислоты рассчитывают по соотношениям:
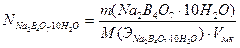
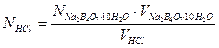
Для установки титра щелочей используют щавелевую кислоту H2C2O4·2H2O или янтарную кислоту H2C4H4O4, например:
Контрольные вопросы
1.Рабочие растворы метода нейтрализации.
2.Чем определяется рН в точке эквивалентности?
3.Какие вещества применяют в качестве исходныхпри установке
титров кислот и щелочей?
Список рекомендуемой литературы
2. Харитонов Ю.Я. Аналитическая химия (аналитика): учебник для вузов.
В 2 кн. Кн. 2. Количественный анализ. Физико-химические (инструментальные) методы анализа. – М.: Высшая школа, 2001. – С.81 – 84, 125-127.
Введение в титриметрический анализ. Метод нейтрализации



Введение в титриметрический анализ
Аналитическая химия – наука о методах определения качественного и количественного состава вещества или их смесей.
Качественный анализ позволяет определить, какие элементы, группы атомов, ионов, молекул, радикалов входят в состав анализируемого вещества или смеси веществ.
Количественный анализ позволяет установить количественные соотношения компонентов данного соединения или смеси веществ.
Исследуя новое соединение, прежде всего, устанавливают, из каких компонентов оно состоит, а затем находят их количественные соотношения. Поэтому качественный анализ вещества предшествует количественному. Если качественный состав анализируемого материала известен, то приступают к количественному анализу, выбрав наиболее подходящий метод.
В настоящее время аналитическая химия пользуется многочисленными и разнообразными методами, которые подразделяют на физические, физико-химические и химические. Химические методы, в свою очередь, включают гравиметрию (весовой анализ) и титриметрию (объемный анализ). Преимущество титриметрического анализа перед гравиметрическим состоит в быстроте определений.
В клинических лабораториях и лабораториях промсанхимии широкое распространение получил титриметрический анализ, так как для его проведения требуется простейшее лабораторное оборудование, не значительные затраты труда и времени, достаточно большая универсальность и высокая точность.
Титриметрический анализ основан на измерении объема титранта (раствора точно известной концентрации), израсходованного на реакцию с определяемым веществом, при этом вещества должны реагировать в строго эквивалентных количествах.
Процесс постепенного добавления титранта к анализируемому веществу называется титрованием, а момент завершения реакции – моментом эквивалентности.
Титриметрическое определение вещества сводится к проведению химической реакции смешиванием растворов двух реагирующих веществ. Эта операция проводится титрованием – добавлением небольших порций раствора одного из веществ к известному объему раствора второго вещества.
Один из двух растворов содержит вещество с неизвестной концентрацией и представляет собой анализируемый раствор. Второй раствор содержит реагент с точно известной концентрацией и называется рабочим раствором или титрантом.
Для проведения титриметрического анализа необходимо:
1) знать точную концентрацию титранта;
2) точно измерить объемы растворов титранта и исследуемого вещества;
3) точно фиксировать момент эквивалентности.
Для точного измерения объемов растворов реагирующих веществ используют мерную посуду – бюретки, пипетки, мерные колбы и пр.
В процессе титрования достигается точка эквивалентности (момент эквивалентности), т. е. момент, когда количество вещества эквивалента в добавленном растворе титранта становиться равным количеству анализируемого вещества.
Химические вещества реагируют между собой в определенных количественных соотношениях. Уравнение реакции показывает минимальные целочисленные количества химических веществ, вступающих в реакцию, а так же образующихся в результате реакции. В общем случае эти количества различны. Однако для удобства расчетов в химии используют особое понятие – химический эквивалент вещества, дающее возможность выразить количества реагирующих и образующихся веществ одинаковыми числами.
Из самого определения понятия химического эквивалента вытекает, что в химической реакции обязательно участвует равное число эквивалентов двух веществ (кислоты и основания, окислителя и восстановителя и т. д.).
Равными оказываются и количества вещества эквивалента тех же веществ:
это равенство представляет собой математическое выражение закона эквивалентов. Выразим количество вещества эквивалента через концентрацию и объем раствора:
С(1/zТ) – молярная концентрация эквивалента титранта, моль/дм 3
V(Т) – объем титранта, см 3
С(1/zХ) – молярная концентрация эквивалента исследуемого вещества, моль/дм 3
V(Х) – объем раствора исследуемого вещества, см 3
Таким образом, в момент эквивалентности число эквивалентов титранта и анализируемого вещества равны.
По достижении точки эквивалентности титрование обычно заканчивают и отмечают затраченный объем раствора. Следовательно, при выполнении титриметрического анализа необходимо располагать методом определения момента эквивалентности. Для этого используют свойства растворов, которые резко меняются в точке эквивалентности.
Момент эквивалентности определяют:
1) с помощью индикаторов;
2) по изменению окраски раствора одного из реагирующих веществ;
3) по прекращению выпадения осадка или изменению цвета осадка;
4) с помощью приборов, например, потенциометров, кондуктометров и пр.
Зная точную концентрацию титранта С(1/zТ), объем исследуемого раствора и объем раствора титранта V(Т) в момент эквивалентности, можно легко рассчитать концентрацию раствора исследуемого вещества С(1/zХ):
Из выше указанного уравнения можно определить титр раствора исследуемого вещества t(Х):
В титриметрическом анализе могут использоваться не все химические реакции, а только те, которые отвечают определенным требованиям:
1) реакция должна быть практически необратимой;
2) реакция должна протекать быстро, в строгом соответствии с законом эквивалентов, без побочных процессов;
3) необходимо точно фиксировать момент эквивалентности.
Разнообразные методы титриметрического анализа можно классифицировать в зависимости от характера химической реакции, лежащей в их основе, и по способу проведения анализа.
Используют следующие основные типы химических реакций:
Ø Кислотно-основное титрование — основано на взаимодействии кислот и оснований.
Ø Оксидиметрия — основана на протекании окислительно-восстановительных реакций.
Ø Осадительное титрование — основано на образовании осадков.
Ø Комплексонометрия — основана на реакциях комплексообразования.
Сущность кислотно-основного титрования (метод нейтрализации)
В основе кислотно-основного титрования лежит соединение ионов Н3О + и гидроксид-ионов ОН – с образованием малодиссоциирующих молекул воды. В упрощенном виде
Метод позволяет определять в растворах не только концентрацию кислот или оснований, но также и концентрацию гидролизующихся солей.
Для определения в растворах концентрации оснований или солей, дающих при протолизе щелочную реакцию, используют в качестве титранта растворы кислот. Эти определения называют ацидиметрией (от лат. аcidum — кислота).
Концентрацию кислот и гидролитически кислых солей определяют с помощью титрантов растворов сильных оснований. Такие определения называют алкалиметрией (от лат. alkali – щелочь).
Поскольку реакция нейтрализации не сопровождается каким-нибудь внешним эффектом, например изменением окраски раствора, точку эквивалентности определяют с помощью индикаторов.
Согласно ионной теории индикаторов Оствальда (1894г.), индикаторы в методе кислотно-основного титрования представляют собой такие слабые органические кислоты или основания, у которых недиссоциированные молекулы и ионы имеют различную окраску.
Индикаторы, обладающие свойством отдавать протоны, называют кислотными индикаторами и обозначают через HInd. Молекула такого индикатора играет роль донора протона, т. е. дает при диссоциации катион Н + и анион Ind – :
Все индикаторы изменяют свою окраску плавно в определенном интервале значений рН, называемом интервалом перехода, или зоной перехода окраски индикатора. Внутри зоны перехода имеется такое значение рН, при котором индикатор наиболее резко изменяет свою окраску. В этот момент концентрации молекулярной и ионной форм индикатора равны [HInd] = [Ind – ]. Значение рН, при котором индикатор наиболее резко меняет свою окраску, называется показателем титрования (рТ).
В табл. 1 указаны область перехода, показатель титрования, окраска недиссоциированных молекул и анионов некоторых индикаторов.
Характеристики некоторых индикаторов
| индикатор | область перехода рН | показатель титрования рТ | окраска недиссоциированных молекул | окраска анионов |
| метилоранж | 3,1 — 4,0 | 4,0 | красная | оранжево-желтая |
| метилрот | 4,2 — 6,2 | 5,5 | красная | желтая |
| лакмус | 5,0 — 8,0 | 7,0 | красная | синяя |
| фенолфталеин | 8,0 — 10,0 | 9,0 | бесцветная | малиновая |
Достаточно к раствору, содержащему фенолфталеин, прибавить немного щелочи, как введенные ионы ОН – станут связывать протоны с образованием малодиссоциирующих молекул воды. При этом равновесие диссоциации индикатора сместится вправо и накопление анионов Ind – вызовет окрашивание раствора в малиновый цвет.
Наоборот, если к раствору фенолфталеина прилить несколько капель кислоты, то повышение концентрации протонов будет подавлять диссоциацию молекул индикатора. Равновесие сместится влево и раствор обесцветится. Аналогичным образом объясняют поведение лакмуса, молекулы которого окрашены в красный цвет, а анионы в синий; нейтральные растворы лакмуса имеют промежуточную фиолетовую окраску. Это подтверждает, что цвет водного раствора индикатора зависит от соотношения между его молекулярной и ионной формами.
Таким образом, окраска молекул индикаторов, обладающих кислотными свойствами, проявляется в кислой среде, а окраска аниона — в щелочной.
В каждом конкретном случае кислотно-основного титрования индикатор подбирается таким образом, чтобы показатель титрования его как можно точнее совпадал с истинным моментом эквивалентности.
На правильный выбор индикатора влияет гидролиз солей, образующихся в процессе титрования. Различают четыре случая выбора индикаторов.
1. Титрование сильного основания сильной кислотой (или наоборот)
Например: HCl + NaOH = NaCl + H2O
Соли катионов сильных оснований и анионов сильных кислот гидролизу не подвергаются, рН раствора 7, поэтому и момент эквивалентности будет при рН = 7. Для фиксирования момента эквивалентности в этом случае применяются любые индикаторы с рТ = 7 (например, лакмус и др.)
2. Титрование сильной кислотой слабого основания
Образующаяся соль подвергается гидролизу: NH4 + + H2O ↔ NH4OH + H +
Среда раствора кислая, рН – + Н2О ↔ CH3COOН + OН –
Среда щелочная, рН > 7, поэтому и момент эквивалентности будет при рН > 7. Для фиксирования момента эквивалентности применимы любые индикаторы с рТ > 7 (например, фенолфталеин и др.).
4. Титрование слабой кислоты слабым основанием (или наоборот)
Такое титрование практически не применяется, т.к. соли катионов слабых оснований и анионов слабых кислот в растворах легко гидролизуются:
В результате гидролиза образуются слабые электролиты, среда раствора остается практически нейтральной, рН = 7. Так как концентрации ионов Н + и ОН – в растворе меняются незначительно, то они не оказывают существенного влияния на смещение индикаторного равновесия. В этом случае индикаторы свою окраску не изменяют, следовательно, слабые кислоты слабыми основаниями (или наоборот) точно не титруются.
Более точно выбор индикаторов проводят по кривым титрования.
Кислотно-основное титрование применяется в клинических лабораториях при определении кислотности желудочного сока, буферной емкости крови, спинномозговой жидкости и пр., что используется при постановке диагноза и лечении больных.
С помощью этого метода анализируются лекарственные вещества, устанавливается доброкачественность пищевых продуктов (молока, хлеба, муки и др.). Большое значение метод нейтрализации имеет при санитарно-гигиенической оценке состояния окружающей среды (природных водоемов, почвы, промышленных стоков и др.).
Контрольные вопросы
1. Принципы титриметрического анализа.
2. Классификация методов титриметрического анализа.
3. Титрование, требования к реакциям объемного анализа.
4. Момент эквивалентности реакции, методы фиксирования момента эквивалентности.
5. Закон эквивалентов, количественные расчеты в объемном анализе.
6. Сущность метода нейтрализации. Ацидиметрия. Алкалиметрия. Применение метода в клинических и санитарно-гигиенических анализах.
7. Индикаторы метода нейтрализации. Ионная теория индикаторов Оствальда.
8. Зона перехода окраски индикатора. Показатель титрования, его значение.
Типовые задачи
Задача 2. Раствор калия перманганата применяется в медицине как дезинфицирующее средство. Рассчитайте титр раствора KMnO4, содержащего 0,02 моль калия перманганата в 250 см 3 раствора.
Тестовые задания для самоконтроля
Метод нейтрализации
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Саратовский государственный технический университет
по аналитической химии для студентов направления 550800
всех форм обучения
редакционно-издательским советом Саратовского государственного технического университета
Химический анализ состава вещества подразделяется на качественный и количественный анализ. Задача качественного анализа определить, из каких атомов или ионов состоит исследуемое вещество. Задача количественного анализа определить, в каком количестве атомы или ионы входят в состав вещества. Методы количественного анализа подразделяются на три большие группы.
физико-химические методы анализа
При титриметрическом анализе измеряется объем реагента, затраченный на реакцию с исследуемым веществом. Современная техника эксперимента позволяет измерить объем реагента с точностью до 10-2 мл. Таким образом, титриметрический анализ значительно уступает гравиметрическому в точности, но позволяет сократить время, затраченное на анализ, до нескольких минут. Такой метод проведения анализа находит широкое применение в заводской практике.
Физико-химические методы анализа основаны на изучении зависимости какого-то конкретного параметра раствора от его состава. Они отличаются высокой точностью (10·г) и быстротой проведения эксперимента. Однако для проведения анализа, как правило, требуется специальная аппаратура. Поэтому наибольшее распространение в производственных условиях получил титриметрический (объемный) анализ.
Особенности титриметрического анализа и условия титрования подробно рассмотрены в данных методических указаниях на примере титрования по методу нейтрализации.
При проведении анализа реагент по каплям добавляют к исследуемому веществу. Такая операция называется титрованием, а метод анализа титриметрическим.
Титрование проводят до установления эквивалентной точки. Эквивалентной точкой называется такое состояние раствора, в котором к исследуемому веществу добавлено строго эквивалентное количество реагента. Момент окончания титрования можно установить при помощи химической реакции или по изменению некоторого физического свойства. Например, при взаимодействии NaOH и НСl эквивалентная точка достигается, когда в реакцию с 40 г NaOH вступает 36,5 г НСl или с 4 г NaOH вступает 3,65 г НСl и т. д.:
NaOH + НСl = NaCl + Н2О

Основной единицей объема в Международной системе единиц (СИ) является м3; тысячная доля м3 это cм3 (тоже миллилитр, мл). Содержание вещества в одном мл раствора называется титром, обозначается Т (г/мл).
Растворы с известным титром называются mитpованными или рабочими. Зная титр и объем рабочего раствора, затраченный на титрование, рассчитывают количество реагента, вступившее в реакцию с исследуемым веществом:
Для приготовления рабочих растворов используют специальные вещества, выбор которых обусловлен типом реакции, имеющей место при титровании.
В соответствии с типом реакции различают следующие методы объемных определений: метод нейтрализации, методы окисления восстановления, методы осаждения и комплексообразования.
Для определения точки эквивалентности в объемном анализе используют специальные вещества индикаторы (иногда индикатором является сам реагент). Для точного измерения объемов исследуемого вещества и реагента в ходе анализа используется специальная мерная посуда: мерные колбы, пипетки, бюретки и т. д. Взвешивание веществ производят в бюксах, доведенных до постоянного веса.
Расчет концентрации исследуемого раствора, в соответствии с законом эквивалентов, проводят по формуле (2). Произведение объема на нормальность для исследуемого вещества и реагента есть величина постоянная
где С1 и С2 молярные концентрации эквивалентов (нормальности) исследуемого вещества и титранта, соответственно, моль экв/л;
V1, объем исследуемого вещества, л;
V2 объем титранта, израсходованный на титрование, л.
При определении концентраций кислот и оснований используют метод кислотно-основного титрования, в основе которого лежит реакция нейтрализации:
С помощью данного метода можно определять концентрацию кислот, щелочей, а также солей, имеющих кислую или щелочную реакцию среды в результате гидролиза. Если в качестве рабочего раствора используется кислота, то метод называется ацидиметрия: если рабочий раствор щелочь алкалиметрия. Точка эквивалентности определяется с помощью индикаторов, изменяющих свою окраску при изменении реакции среды.
Для проведения анализа необходимо приготовить стандартные рабочие растворы, титрованные рабочие растворы, а также правильно выбрать индикатор. Стандартными· рабочими растворами в ацидиметрии являются растворы буры Na2B407∙10H20 или соды Nа2СОз ∙5Н2О; титрованными рабочими растворами растворы хлороводородной кислоты, реже других кислот. В алкалиметрии стандартными рабочими растворами являются растворы щавелевой кислоты Н2С2О4∙2Н2О или оксалата натрия Na2C2О4·2H2О.
Метод нейтрализации как метод количественного анализа получил широкое распространение, т. к. реакция среды (рН среды) определяет направление целого ряда физико-химических процессов и химических реакций. Например, процессы окисления восстановления, образования и растворения осадков, коррозии металлов, дубления кожи и т. д. зависят от реакции среды. Таким образом, в производственных условиях постоянно возникает необходимость контролировать реакцию среды.
Лабораторные работы, включенные в данные методические указания, позволяют приобрести необходимые практические навыки для контроля реакции среды и выполняются каждым студентом самостоятельно.
ОБЩИЕ ЦЕЛИ И ЗАДАЧИ ЛАБОРАТОРНОГО ПРАКТИКУМА ПО АНАЛИТИЧЕСКОЙ ХИМИИ
1. Ознакомление с приемами и методами проведения химического анализа.
2. Изучение особенностей объемного анализа.
3. Ознакомление с методиками приготовления рабочих растворов, стандартных рабочих растворов и вспомогательных веществ.
4. Приобретение практических навыков стандартизации веществ и определения концентрации исследуемых растворов.
5. Приобретение практических навыков прямого, обратного и заместительного титрования.
6. Ознакомление с особенностями проведения расчетов.
СОДЕРЖАНИЕ И ОФОРМЛЕНИЕ ОТЧЕТОВ
О ЛАБОРАТОРНЫХ РАБОТАХ 1-5
Студент пишет отчет о выполненной работе в тетради для лабораторных занятий. Этот отчет должен содержать следующие пункты:
1) номер и название лабораторной работы;
2) формулировку цели работы;
3) основные теоретические положения;
4) порядок выполнения работы;
5) экспериментальные данные;
6) расчеты и выводы по работе.
1. Ознакомиться с техникой безопасности и правилами работы в лаборатории аналитической химии.
2. Получить у лаборанта посуду (колбы и бюкс).
3. Вымыть, высушить и подписать посуду.
5. Определить объем капли дистиллированной воды, вытекающей из бюретки.
6. Приступить к выполнению лабораторных работ.
ТРЕБОВАНИЯ БЕЗОПАСНОСТИ ТРУДА
1. Все операции с концентрированными кислотами и щелочами следует проводить только под тягой.
2. Нагревать растворы следует только в специальной тугоплавкой посуде и под тягой.
3. При отмеривании кислот и щелочей следует пользоваться мерными и измерительными пипетками и цилиндрами.
4. Набирать жидкость в пипетки следует только с помощью груши.
Лабораторная работа 1
ПРИГОТОВЛЕНИЕ СТАНДАРТНОГО РАБОЧЕГО РАСТВОРА БУРЫ
Цель работы: приготовить 200 мл 0,1н раствора буры.
Рабочие растворы подразделяются на стандартные и установленные растворы.
Стандартными называются растворы, которые получают путем растворения точной навески вещества в строго определенном объеме жидкости. Титр таких растворов определяют по формуле:
Т = 
где a навеска вещества, г; V объем колбы, мл.
Для приготовления стандартных рабочих растворов пригодны вещества, которые удовлетворяют следующим требованиям:
1) вещество должно быть получено в химически чистом виде;
2) состав вещества должен строго отвечать формуле;
3) состав вещества не должен изменяться при хранении;
4) вещество должно иметь достаточно высокую эквивалентную массу, что позволяет уменьшить процент ошибки при взвешивании.
где а – навеска вещества, г;
Сн нормальность раствора;
Мэ масса эквивалентная вещества, г/моль;
V объем раствора, мл.
Мэ= (Na2B407·10Н2О) = М (Nа2В4О7 10Н2О) / 2 = 2 ·22,9897 + 4·10,8100 + 7·15,994 + 20· 1,0079 + 10 ·15,9994 = 381,3672 /2 = =190,6836 (г/моль)
2. Взвешивание буры:
а = 0,1∙190,6836·200/1000 = 3,8137 (г)
Масса пустого бюкса на технических весах а1.
Масса пустого бюкса на аналитических весах а2.
Теоретическая масса бюкса с навеской а3 =(а2 + 3,8137).
Масса бюкса с навеской на технических весах а4.
Масса бюкса с навеской на аналитических весах a5.
3. Растворение буры.
Навеску буры из бюкса количественно переносят в мерную колбу на 200мл через воронку. Все кристаллики буры на стенках бюкса и на воронке тщательно смывают в колбу. Бура плохо растворяется в воде, поэтому для ее растворения в колбу наливают небольшое количество горячей дистиллированной воды (150 мл). Содержимое колбы осторожно перемешивают. После того как бура растворится в воде, колбу охлаждают до комнатной температуры и доводят объем в колбе до метки дистиллированной водой комнатной температуры. Колбу плотно закрывают и раствор тщательно перемешивают. Приготовленный раствор переливают в плоскодонную колбу.
4. Расчет нормальности и титра буры.
Рассчитать поправочный коэффициент:
К = апр / атеор = апр / 3,81
Рассчитать нормальность буры:
Cн (практ) = К Сн (теор) = К 0,1. (7)
Рассчитать титр буры:
Т=Сн(практ) ·Мэ(буры) / 1000; (8)
Лабораторная работа 2
ПРИГОТОВЛЕНИЕ РАБОЧЕГО РАСТВОРА ХЛОРОВОДОРОДНОЙ КИСЛОТЫ
Цель работы: приготовить 500 мл 0,1 н хлороводородной кислоты HCl.
Промышленная хлороводородная кислота представляет собой жидкость, содержащую примеси и не пригодную для приготовления стандартных растворов. Поэтому из НСl готовят раствор приблизительно заданной нормальности, а точную нормальность устанавливают по стандартному рабочему раствору или по титрованному раствору. Для приготовления растворов из технической кислоты неизвестной процентной концентрации необходимо измерить плотность кислоты с помощью денситометров, затем по справочнику найти процентную концентрацию кислоты и только после этого приступить к приготовлению кислоты.
1. Определение плотности и процентной концентрации кислоты HCl.
где, а навеска вещества, г;
Сн нормальность раствора;
Мэ масса эквивалентная вещества, г/моль;
V объем раствора, мл.
3. Расчет массы 18%-ной кислоты, необходимой для приготовления раствора:
Зная m (HCl) (навеска п. 2), находим m (раствора HCl).
4. Расчет объема 18%-ной HCl, необходимого для приготовления кислоты:
V(раствора HCl) = m (раствора HCl) ∙ρ. (12)
5. Приготовление 500 мл 0,1 н HCl.
Необходимый для приготовления объем кислоты, рассчитанный по п. 4, отмерить цилиндром и перенести в мерную колбу на 500 мл. Довести объем в колбе до метки дистиллированной водой, добавляя ее небольшими порциями и тщательно перемешивая содержимое колбы. Приготовленный раствор перенести в плоскодонную или коническую колбу.
Лабораторная работа 3
ОПРЕДЕЛЕНИЕ НОРМАЛЬНОСТИ И ТИТРА ХЛОРОВОДОРОДНОЙ КИСЛОТЫ
Цель работы: установить нормальность приготовленного раствора НСl по стандартному раствору буры.
Для определения нормальности и титра кислоты необходимо оттитровать кислоту раствором буры. Чтобы определить точку эквивалентности, при титровании необходимо воспользоваться индикаторами. Индикаторами называются вещества, изменяющие свою окраску при изменении реакции среды. Индикаторы в большинстве случаев слабые органические кислоты или основания. В общем виде формулу кислоты или основания можно представить следующим образом:
Индикатор изменяет окраску, т. к. его молекулы и ионы окрашены в разные цвета. Если в растворе преобладают молекулы, то раствор имеет цвет молекул, и наоборот. Равновесие между молекулами и ионами индикатора можно сместить, изменяя реакцию среды. Например, слабая кислота частично диссоциирует по уравнению:
При добавлении H+ равновесие диссоциации смещается в сторону недиссоциированных молекул кислоты. Кислая среда подавляет диссоциацию, раствор имеет окраску молекул. В щелочной среде Н+ и ОН- взаимодействуют, и равновесие диссоциации смещается в сторону образования ионов. Щелочная среда способствует диссоциации, раствор приобретает окраску ионов. Изменение окраски индикатора происходит в некотором интервале рН, который называется интервалом перехода окраски индикатора. Центральная точка этого интервала называется показателем титрования, обозначается рТ (табл. 1).
Интервалы перехода окраски некоторых индикаторов










